Ein Überblick über die Wirksamkeitsprüfung von Desinfektionsmitteln – die Relevanz einer nassen Einwirkzeit

Einführung
Die Verwendung von Desinfektionsmitteln als Mittel zur Kontrolle der mikrobiologischen Kontamination einer Umgebung ist allgemein anerkannt und wird sowohl in Europa als auch in den Vereinigten Staaten von Regulierungsbehörden geregelt.
Die Biozidprodukte-Verordnung (Biocidal Products Regulation, BPR) 528/2012 [1] regelt die Vermarktung und Verwendung von Biozidprodukten in Europa. Chemische Desinfektionsmittel werden in den Vereinigten Staaten von der US-Umweltschutzbehörde (EPA) im Rahmen des Federal Insecticide, Fungicide, and Rodenticide Act (FIFRA) (40 CFR Teil 150–189) [2] registriert und reguliert. Unter FIFRA gelten chemische Desinfektionsmittel als „antimikrobiologische Pestizide“.
Zu den klaren Anforderungen der BPR bzw. der EPA bei der Registrierung von Desinfektionsmitteln durch die Hersteller gehören Daten, die den Wirksamkeitsanspruch eines Desinfektionsmittels belegen. Es spielt dabei keine Rolle, ob es sich um ein bakterizides, fungizides, sporizides oder viruzides Desinfektionsmittel handelt.
Auch die Endnutzer von Desinfektionsmitteln in der Pharmazeutik müssen Nachweise für deren Wirksamkeit erbringen. In den Leitlinien der US Food and Drug Administration (FDA) für die Pharmazeutik heißt es: „Die Eignung, Wirksamkeit und Grenzen von Desinfektionsmitteln und -abläufen sollten bewertet werden. Die Wirksamkeit dieser Desinfektionsmittel und -abläufe sollte an ihrer Fähigkeit gemessen werden, potenzielle Kontaminierungsstoffe in angemessener Weise von Oberflächen entfernen zu können.“ [3] Innerhalb Europas werden ähnliche Anforderungen von der Europäischen Kommission gestellt: „4.37 Der Desinfektionsprozess sollte validiert werden. Validierungsstudien sollten die Eignung und Wirksamkeit von Desinfektionsmitteln in der spezifischen Art und Weise, in der sie verwendet werden, nachweisen und die Verfallszeiten der gebrauchsfertigen Lösungen bei der Verwendung unterstützen.“ [4]
Methoden zum Nachweis der Wirksamkeit
In Europa müssen Desinfektionsmittelhersteller ihre Ansprüche auf mikrobiozide Wirksamkeit mittels der in der Europäischen Norm (EN) 14885:2018 [5] aufgeführten, erforderlichen Prüfmethoden (EN-Normen) nachweisen. In den Vereinigten Staaten enthält die EPA-Richtlinie zur Produktleistungsprüfung OCSPP 810.2100 Details zu den Prüfmethoden (der Association of Official Analytical Chemists (AOAC)), welche von Desinfektionsmittelherstellern zum Nachweis von Auslobungen hinsichtlich der mikrobioziden Wirksamkeit anzuwenden sind.
Diese Prüfmethoden können in zwei Kategorien unterteilt werden:
- Suspensionsprüfung
z. B. EN 1276 Chemische Desinfektionsmittel und Antiseptika. Quantitative Suspensionsprüfung zur Bewertung der bakteriziden Wirkung chemischer Desinfektionsmittel und Antiseptika, die in der Lebensmittelbranche sowie im industriellen, häuslichen und institutionellen Bereich verwendet werden. Prüfmethode und -anforderungen (Phase 2, Schritt 1).
EN 1650 Chemische Desinfektionsmittel und Antiseptika. Quantitative Suspensionsprüfung zur Bewertung der fungiziden Wirkung chemischer Desinfektionsmittel und Antiseptika, die in der Lebensmittelbranche sowie im industriellen, häuslichen und institutionellen Bereich verwendet werden. Prüfmethode und -anforderungen (Phase 2, Schritt 1).
Offizielle AOAC-Methode 955.15 Prüfung von Desinfektionsmitteln gegen Staphylococcus aureus, Anwendungs-Verdünnungsmethode.
- Oberflächenprüfung
z. B. DE 13697 Chemische Desinfektionsmittel und Antiseptika – Quantitative Prüfung nichtporöser Oberflächen zur Bewertung der bakteriziden und/oder fungiziden Wirkung chemischer Desinfektionsmittel, die in der Lebensmittelbranche sowie im industriellen, häuslichen und institutionellen Bereich verwendet werden – Prüfverfahren und Anforderungen ohne mechanische Einwirkung (Phase 2, Schritt 2).
Offizielle AOAC-Methode 961.02 Keimtötende Sprayprodukte als Desinfektionsmittel.
Die verschiedenen Prüfmethoden verwenden jeweils spezifische Ausgangsinokula, Organismen, Log-Reduktionen und Einwirkzeiten.
Um Auslobungen der Wirksamkeit von Desinfektionsmitteln in Europa geltend zu machen, führen deren Hersteller in der Regel die EN-Tests durch. Die EN-Testnummern können auf den Produktetiketten zusammen mit den in der Methode verwendeten Standardeinwirkzeiten angegeben werden. In der Regel werden die Standard-Prüfmethoden verwendet, da sie robust, reproduzierbar und weithin anerkannt sind. Auch für Endnutzer kann es hilfreich sein, auf die Ergebnisse von Standardprüfungen zurückgreifen zu können, um Produkte verschiedener Hersteller zu vergleichen.
Für den Endnutzer eines Desinfektionsmittels spiegeln die Standard-Prüfmethoden möglicherweise nicht genau die Bedingungen in seinem eigenen pharmazeutischen Reinraum wider. In den Reinräumen von Endnutzern gibt es in der Regel andere Oberflächenmaterialien, andere Mikroorganismen und andere Umgebungsbedingungen (wie niedrige Luftfeuchtigkeit, schnelle Trocknung aufgrund von Klimaanlagen).
Kapitel <1072> [7] der United States Pharmacopoeia (USP) enthält weitere Hinweise zur Wirksamkeitsprüfung für die Pharmazeutik: „Um die Wirksamkeit eines Desinfektionsmittels in einer pharmazeutischen Herstellungsumgebung nachzuweisen, können die folgenden Prüfungen erforderlich sein: (1) Anwendungs-Verdünnungsprüfungen (Prüfung von Desinfektionsmitteln auf ihre Wirksamkeit bei verschiedenen Konzentrationen und Einwirkzeiten gegenüber einer Vielzahl von Standard-Testorganismen und Umweltisolaten); ({2) Oberflächen-Herausforderungsprüfungen von Desinfektionsmitteln (unter Verwendung von Standard-Testmikroorganismen und Mikroorganismen, die typische Umweltisolate sind, Auftragen der Desinfektionsmittel in der gewählten Anwendungskonzentration auf Oberflächen und Bestimmung der Log-Reduktionen der Herausforderungs-Mikroorganismen nach einer festgelegten Einwirkzeit); und (3) ein statistischer Vergleich der Häufigkeit der Isolierung von Mikroorganismen, die vor und nach der Einführung eines neuen Desinfektionsmittels isoliert wurden.
Dies wird als notwendig erachtet, da kritische Prozessschritte wie die Desinfektion von aseptischen Verarbeitungsbereichen entsprechend den GMP-Vorschriften validiert werden müssen und die Registrierungsanforderungen der EPA nicht darauf eingehen, wie Desinfektionsmittel in der pharmazeutischen, biotechnologischen und medizintechnischen Branche tatsächlich verwendet werden.
Die Nutzung verschiedener Mikroorganismen und Testoberflächen in Standard-Prüfmethoden in Übereinstimmung mit der USP-Richtlinie ist relativ einfach. Die Einhaltung der spezifizierten Einwirkzeiten der Standard-Prüfmethoden kann sich jedoch unter den jeweiligen Umgebungsbedingungen eines pharmazeutischen Reinraums als schwierig erweisen. Die Verdampfungsrate eines Desinfektionsmittels, das durch Wischen in einem Reinraum mit hohem Luftaustausch auf eine Oberfläche aufgebracht wird, könnte sich signifikant von der Verdampfungsrate unter Laborbedingungen unterscheiden. Das wirft die Frage auf, ob die Oberfläche für die angegebene Zeitdauer sichtbar mit dem Desinfektionsmittel befeuchtet sein muss, um eine Wirkung zu erzielen. Damit einher geht die Frage, was genau man sich unter Einwirkzeit vorzustellen hat.
Definitionen der Einwirkzeit
Um festzustellen, ob es zu den regulatorischen Anforderung für die Pharmazeutik gehört, dass Oberflächen für die Dauer der Einwirkzeit sichtbar nass sind (im Folgenden als „Nasseinwirkzeit“ bezeichnet), wurden die Vorschriften überprüft.
Weder in den Richtlinien der USA [3],[8] noch in der EU GMP [4] oder im Pharmaceutical Inspection Co-operation Scheme [9] ist der Begriff „Einwirkzeit“ definiert. Das Europäische Arzneibuch (EP) enthält keinerlei Leitlinien zur Prüfung der Wirksamkeit von Desinfektionsmitteln. Im Gegensatz dazu wird der Begriff „Einwirkzeit“ zwar im USP-Kapitel 1072 [7] häufig verwendet, der Definitionsteil des Kapitels geht jedoch nicht näher auf dessen Bedeutung ein. Auch die ISO-Norm für Reinräume (ISO 14644 Teil 5 [10]) enthält keine Definition.
Da die Vorschriften für die Pharmazeutik keine klare Definition bereitstellen, wurde eine breitere Suche in anderen anwendbaren regulatorischen Dokumenten und anerkannten Leitlinien der Pharmazeutik durchgeführt.
Die Royal Pharmaceutical Society/das NHS Pharmaceutical Quality Assurance Committee gibt eine Anleitung zum Auftragen von Desinfektionsmitteln mit folgendem Wortlaut: „Eine Ansammlung überschüssiger Mengen an Reinigungs- und Desinfektionsmitteln sollte vermieden werden. Idealerweise sollten die Oberflächen innerhalb von 1 Stunde nach dem Auftragen trocknen. Andererseits sollte genügend Produkt verbleiben, um die erforderliche Wirksamkeit während der empfohlenen Einwirkzeit zu erzielen, d. h. Desinfektionsmittel sollten nicht zu dünn aufgetragen werden.“ [11] Diese Aussage impliziert, dass eine Nasseinwirkzeit erforderlich ist, um die Wirksamkeit zu erzielen.
Die EN- und AOAC-Methoden schreiben keine „Nasseinwirkzeit“ vor. Bei Suspensionsprüfungen wird generell mit einer „Nasseinwirkzeit“ gearbeitet, da das Desinfektionsmittel für diese Prüfung in eine Organismussuspension gegeben und während der erforderlichen Einwirkzeit in der Lösung belassen werden muss. Am Ende der Einwirkzeit wird ein Produktneutralisator zugegeben.
Bei Oberflächenprüfungen ist die Situation jedoch nicht so klar, da eine in der Norm definierte Menge des Desinfektionsmittels auf die Oberfläche pipettiert wird, ohne diese zu verteilen. Aufgrund der geringen Mengen, die per Pipette aufgetragen werden, und der relativ hohen Oberflächenspannung der meisten getesteten Desinfektionsmittel ist es wahrscheinlich, dass unter Laborbedingungen eine Nasseinwirkzeit erzielt wird.
Die EN-Oberflächenprüfung mit mechanischer Einwirkung EN 16615 [12] ist die Prüfmethode, die der praktischen Anwendung von Desinfektionsmitteln am nächsten kommt, denn sie umfasst das Auftragen eines Desinfektionsmittels auf eine Oberfläche durch Wischen. Der Abschnitt „Experimentelle Bedingungen“ enthält die folgenden Informationen zur Einwirkzeit: „Die Einwirkzeiten für Flächendesinfektionsmittel werden auf der Grundlage der praktischen Bedingungen des Produkteinsatzes gewählt. Die empfohlene Einwirkzeit für die Verwendung des Produkts liegt in der Verantwortung des Herstellers.“ Aus der Formulierung „praktische Bedingungen des Produkteinsatzes“ könnte abgeleitet werden, dass sie sich auf durch Moppen oder Wischen aufgebrachte Mengen und Verdampfungsraten beziehen, z. B. Alkohol im Vergleich zu einer quaternären Ammoniumverbindung, aber auch das ist keine klare Definition.
Die Technische Monographie 20 der Pharmaceutical and Healthcare Sciences Society (PHSS) enthält im Abschnitt 3.3.4 folgende Informationen: „Die Coupons werden dem Desinfektionsmittel für die definierte Nass-/Verweil-Einwirkzeit ausgesetzt.“ [13] Diese Aussage stellt klar, dass es sich um eine Nasseinwirkzeit handelt.
Die Richtlinie des US Center for Disease Control and Prevention (CDC) [14] enthält die folgende Glossardefinition der Einwirkzeit: „Die Zeit, während der ein Desinfektionsmittel direkten Kontakt mit der zu desinfizierenden Oberfläche oder dem zu desinfizierenden Gegenstand hat. Bei der Oberflächendesinfektion beginnt dieser Zeitraum beim Auftragen auf die Oberfläche und endet zum Zeitpunkt der vollständigen Trocknung.“ Diese Definition stellt ebenfalls klar, dass es sich um eine Nasseinwirkzeit handelt.
Die Richtlinie zur Prüfung der Produktleistung, OCSPP 810.2000 [15], enthält folgende Informationen zur Einwirkzeit: „Die in der Wirksamkeitsprüfung verwendete Einwirkzeit sollte genauso lang oder kürzer als die auf dem Produktetikett angegebene Einwirkzeit sein. Wenn eine andere Einwirkzeit als die in der Prüfmethode oder der Leitlinie festgelegte Zeitspanne bevorzugt wird, empfiehlt sich eine Rücksprache mit der Behörde vor der Prüfung. Gegebenenfalls ist eine Modifikation des Standardansatzes erforderlich. In den meisten Fällen wird eine Modifikation zugunsten einer längeren Einwirkzeit durch die Berücksichtigung der Verwendungsmuster in der Praxis eingeschränkt (z. B. eine Einwirkzeit von >10 Minuten für ein Produkt, das wahrscheinlich innerhalb von 10 Minuten von der behandelten Oberfläche verdunstet). Achten Sie darauf, alle Methodenänderungen im Prüfprotokoll klar und deutlich zu identifizieren und zu begründen. Bei flüssigen oder Sprayprodukten, die flüchtige Wirkstoffe enthalten und auf feste, nichtporöse Oberflächen aufgetragen werden, kann die maximale Einwirkzeit durch visuelle Kontrolle der Verdunstung während der vorgeschlagenen Einwirkzeit bestimmt werden.“ Auch diese Aussage stellt klar, dass es sich um eine Nasseinwirkzeit handelt.
Der technische PDA-Bericht 70 [16] bietet die folgende Glossardefinition: „Die Mindestdauer, während der ein Desinfektionsmittel oder Sporizid in vollständigem (nassem) Kontakt mit der zu behandelnden Oberfläche verbleiben muss, um wirksam zu sein.“ Diese Definition verweist unmissverständlich auf eine Nasseinwirkzeit.
Das Pharmig-Handbuch zur Verwendung von Desinfektionsmitteln [17] enthält den folgenden Text: „Eine schnellere Verdunstung des Desinfektionsmittels kann auf warmen Oberflächen oder dort auftreten, wo die behandelte Oberfläche einer niedrigen Luftfeuchtigkeit oder hohen Luftströmen ausgesetzt ist, wie sie teilweise in Reinräumen anzutreffen sind.“ Diese Aussage impliziert, dass eine Nasseinwirkzeit erforderlich ist, um die Wirksamkeit zu erzielen.
Aus den obigen Auszügen aus angesehenen Veröffentlichungen der Pharmazeutik geht klarer hervor, dass es sich um eine nasse Einwirkzeit handeln muss.
Es ist nicht auszuschließen, dass die desinfizierende Wirkung auch dann noch anhält, wenn die Oberfläche sichtbar trocken ist, da die Aktivität auf zellulärer Ebene stattfindet. Die erste Phase der mikrobiologischen Abtötung ist die Aufnahme des im Desinfektionsmittel enthaltenen Wirkstoffs durch die Zelle. Es kann daher von zwei „Zeiträumen“ bei der Desinfektion ausgegangen werden (Abbildung 1).
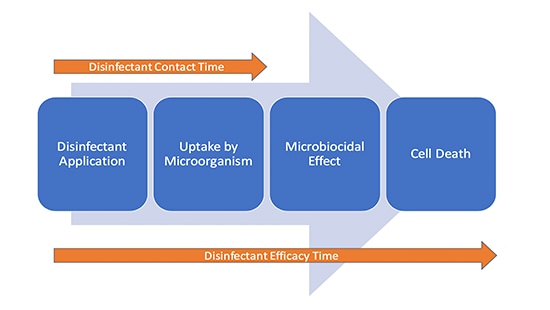
Fazit
Um die Wirksamkeit eines Desinfektionsmittels nachzuweisen, muss dessen Anbieter Standardtests unter wiederholbaren Bedingungen durchführen und auf deren Grundlage eine Einwirkzeit definieren. Diese Einwirkzeit kann sich für den Endnutzer bei der Auswahl des geeigneten Desinfektionsmittels als hilfreich erweisen.
Auch der Endnutzer muss die Wirksamkeit des Desinfektionsmittels validieren, und zwar unter Berücksichtigung der Einsatzbedingungen in seiner Einrichtung, einschließlich der Festlegung einer in der Praxis einzuhaltenden Einwirkzeit.
Die meisten pharmazeutischen Beratungsorganisationen definieren die Einwirkzeit als Nasseinwirkzeit.
Es gibt nur wenige veröffentlichte Studien bezüglich der Leistung von Desinfektionsmitteln, nachdem Oberflächen sichtbar trocken sind. Dies ist auch in der Praxis nicht messbar, da der Anwender den als Endpunkt geltenden Zelltod nicht beobachten kann.
Endnutzern wird empfohlen, bei Prüfungen, welche die Bedingungen in ihrer jeweiligen Einrichtung repräsentieren sollen, die Zeit zu messen, die vergeht, bis die Desinfektionsmittel bei Auftragen durch Routineverfahren (Wischen/Moppen) verdunstet sind. Bei Laboruntersuchungen sollte dann diese Einwirkzeit genutzt werden.
Referenzen:
- Verordnung (Eu) Nr. 528/2012 des Europäischen Parlaments und des Rates vom 22. Mai 2012 zur Bereitstellung auf dem Markt und der Verwendung von Biozidprodukten
- Title 40 of the Code of Federal Regulations (40 CFR) Subchapter E Pesticide Programs Parts 150-189 (Artikel 40 des Code of Federal Regulations (40 CFR) Unterkapitel E Pestizidprogramme Teil 150-189)
- FDA Guidance for Industry – Sterile Drug Products Produced by Aseptic Processing, Current Good Manufacturing Practice (2004) (FDA-Leitlinien für die Industrie – Sterile Arzneimittelprodukte, die durch aseptische Verarbeitung hergestellt werden, aktuelle gute Herstellungspraxis (2004))
- EudraLex-Band 4 EU-Leitlinien zur guten Herstellungspraxis von Human- und Tierarzneimitteln Anhang 1 Herstellung von sterilen Arzneimitteln (Entwurf v.12, veröffentlicht im Februar 2020)
- EN 14885:2018 Chemische Desinfektionsmittel und Antiseptika. Anwendung der europäischen Normen für chemische Desinfektionsmittel und Antiseptika
- EPA Product Performance Test Guideline, OCSPP 810.2100, Sterilants, Sporicides, and Decontaminants, Guidance for Efficacy Testing, [EPA 712-C-17-003] (EPA-Richtlinie zu Produktleistungstests, OCSPP 810.2100, Sterilisationsmittel, Sporizide und Dekontaminationsmittel, Leitfaden für Wirksamkeitstests, [EPA 712-C-17-003])
- United States Pharmacopoeia (USP) chapter 1072 Disinfectants and Antiseptics (Arzneibuch der Vereinigten Staaten (USP) Kapitel 1072 Desinfektionsmittel und Antiseptika)
- The Code of Federal Regulations CFR Title 21 – Food and Drugs: Parts 1 to 1499 (Codex für Bundesverordnungen CFR Kapitel 21 – Lebensmittel und Medikamente: Teil 1 bis 1499)
- PICS GUIDE TO GOOD MANUFACTURING PRACTICE FOR MEDICINAL PRODUCTS ANNEXES PE 009-14 (PICS LEITFADEN ZUR GUTEN HERSTELLUNGSPRAXIS FÜR ARZNEIMITTEL ANHÄNGE PE 009–14)
- ISO 14644 Part 5 Cleanrooms and associate controlled environments - Part 5: Operations, 2004 (ISO 14644 Teil 5 Reinräume und zugehörige kontrollierte Umgebungen – Teil 5: Abläufe, 2004)
- Royal Pharmaceutical Society. Quality Assurance of Aseptic Preparation Services: Standards. (Qualitätssicherung für aseptische Zubereitungsdienste: Normen.) Teil A 5. Ausgabe 2016
- EN 16615 Chemische Desinfektionsmittel und Antiseptika – Quantitatives Prüfverfahren zur Bewertung der Wirksamkeit gegen Bakterien und Hefen auf nichtporösen Oberflächen mit mechanischer Einwirkung unter Verwendung von Wischtüchern im medizinischen Bereich (4-Feldtest) – Prüfverfahren und Anforderungen (Phase 2, Schritt 2)
- Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 Bio-Contamination characterisation, control, monitoring and deviation management in controlled / GMP classified areas (Technische Monographie 20 Charakterisierung, Kontrolle, Überwachung und Abweichungsmanagement von Biokontamination in kontrollierten/GMP-klassifizierten Bereichen)
- Centers for Disease Control and Prevention (CDC) Guideline for Disinfection and Sterilization in Healthcare Facilities (2008) (Leitfaden für die Desinfektion und Sterilisation in Einrichtungen des Gesundheitswesens (2008))
- Product Performance Test Guideline, OCSPP 810.2000, General Considerations for Testing Public Health Antimicrobial Pesticides, Guidance for Efficacy Testing, [EPA 712-C-17-002] (Leitfaden für Produktleistungstests, OCSPP 810.2000, Allgemeine Überlegungen zur Prüfung antimikrobieller Pestizide für das öffentliche Gesundheitswesen, Leitfaden für Wirksamkeitstests, [EPA 712-C-17-002])
- Parenteral Drug Association (PDA) Technical Report No. 70. The Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities (2015). (Grundlagen von Reinigungs- und Desinfektionsprogrammen für aseptische Produktionsanlagen (2015)).
- Pharmig Guide to Disinfectants and their use in the Pharmaceutical Industry (2017) (Pharmig Handbuch für Desinfektionsmittel und deren Verwendung in der Pharmazeutik (2017))
- West AM, Teska, PJ, Oliver HF: There is no additional bactericidal efficacy of Environmental Protection Agency registered disinfectant towelettes after surface drying or beyond label contact time. (Es gibt keine zusätzliche bakterizide Wirksamkeit von bei der Umweltschutzbehörde registrierten Desinfektionstüchern nach dem Trocknen der Oberfläche oder über die auf dem Etikett angegebene Einwirkzeit hinaus.) Am J Infect Control 2019; 47: 27-32



