Die Bedeutung des Schutzes Ihres Sterilitätstestverfahrens
Während des gesamten Produktionsprozesses werden Produktproben entnommen und auf mikrobielle Kontamination untersucht. In den meisten Fällen zeigt die Sterilitätsprüfung, dass das Produkt frei von Verunreinigungen ist und versendet werden kann. Weisen die Ergebnisse auf ein kontaminiertes Produkt hin, wird die Lieferung gestoppt, um zu verhindern, dass Patienten einem potenziellen Risiko ausgesetzt werden.
Wenn Ihr Sterilisationsprozess nicht ausreichend geschützt ist, kann eine Kontamination aus der Umgebung den Test beeinflussen und das Produkt als kontaminiert anzeigen, obwohl es nicht kontaminiert ist. Dies kann zu erheblichen Kosten für den Hersteller und möglicherweise zu Arzneimittelknappheit für die Patienten führen, wenn die Charge entsorgt werden muss. Schützen Sie die Sterilitätsprüfung vor Kontaminationen in der Umgebung, um das Risiko falsch positiver Ergebnisse zu verringern.
Sowohl bei der Membranfiltration als auch bei der Direktbeimpfung kann ein Isolator deutliche Vorteile bieten.

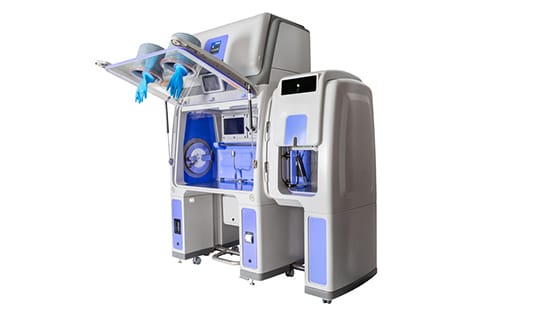
Entdecken Sie unseren Isolator für Sterilitätsprüfungen
Der Bioquell Qube von Ecolab bietet eine aseptische Umgebung nach ISO 5 / Klasse A und verfügt über eine integrierte Bioquell-Wasserstoffperoxid-Dampftechnologie*, die eine validierte 6-log-sporizide Abtötung auf exponierten Oberflächen in Produktionsbereichen erzielt. Von der Polymerformung bis zur Integration in die Sterilitätspumpe Symbio Flex von Merck Millipore ist der Bioquell Qube wirklich einzigartig und eine ideale Lösung für Sterilitätsprüfungen.
*Ecolab Bioquell-Systeme verwenden bei bestimmungsgemäßer Verwendung Bioquell Wasserstoffperoxid-Sterilant-AQ (EPA-Registrierungs-Nr.: 1677-277)
Ist ein Isolator die richtige Wahl für Sie? Haben Sie den richtigen Isolator?
Was würde ein falsch positives Ergebnis oder ein Problem für Sie bedeuten?
Eine Produktionsunterbrechung aufgrund eines falsch-positiven Ergebnisses könnte zu erheblichen Ausfallzeiten, unnötiger Entsorgung von Produkten und Engpässen bei Arzneimitteln führen und möglicherweise das Ansehen eines Unternehmens auf dem Markt schädigen. Außerdem müssten der zusätzliche Zeit-, Arbeits- und Kostenaufwand für CAPA-bezogene Schritte berücksichtigt werden.
Wie viel Platz im Reinraum wird für das Verfahren benötigt?
Reinräume müssen in der Regel optimiert werden, da die Kosten pro Quadratmeter für den Bau und den Betrieb der Reinräume sehr hoch sein können. Ein Isolator wie der Bioquell Qube benötigt wenig Platz, kann bei Bedarf sogar leicht versetzt werden, erfordert keine baulichen Maßnahmen und kann auch in weniger gut ausgestatteten Bereichen eingesetzt werden. Für Spezifikationen wenden Sie sich bitte an Ecolab.
Ist für Ihre Sterilitätsprüfung ein Reinraum der Klasse B erforderlich?
Isolatoren ermöglichen die Durchführung von Prüfungen in Reinräumen niedrigerer Klassen, die weniger oder keine Schutzkleidung erfordern. Darüber hinaus kann wertvoller Reinraum für andere kritische Prozesse erhalten werden und dazu beitragen, die Betriebskosten zu senken, da Reinräume höherer Qualität höhere Investitionen in Energie und Wartung erfordern.
Ist Ihr derzeitiger Prozess validiert und wirklich wiederholbar?
Die automatisierte Biodekontamination des eingehenden Materials ist ein validiertes Verfahren, das bei jedem Zyklus die gleiche Wirksamkeit gewährleistet. Dies trägt weiter dazu bei, das Risiko eines falsch positiven Ergebnisses zu verringern.
Wie viele Sterilitätsprüfungen müssen Sie an einem Tag durchführen?
Reinräume müssen in der Regel optimiert werden, da die Kosten pro Quadratmeter für den Bau und den Betrieb der Reinräume sehr hoch sein können. Ein Isolator wie der Bioquell Qube benötigt wenig Platz, kann bei Bedarf sogar leicht versetzt werden, erfordert keine baulichen Maßnahmen und kann auch in weniger gut ausgestatteten Bereichen eingesetzt werden. Der Bioquell Qube kann beispielsweise je nach Konfiguration bis zu 60 Tests pro Tag durchführen. Für Spezifikationen wenden Sie sich bitte an Ecolab.
Lagern Sie Ihren Sterilitätsprüfungsprozess aus?
Die Vorteile der internen Durchführung des Prozesses sind eine bessere Kontrolle über den Prozess, langfristige Kosteneinsparungen und schnellere Ergebnisse. Durch die Wahl eines Isolators, der in CNC-Bereichen oder Reinräumen niedrigerer Klasse aufgestellt werden kann, können Unternehmen dies trotz der anfänglichen Kosten für die Ausrüstung umsetzen.

Die Folgen von Fehlern
Die Auswirkungen einer nicht bestandenen Prüfung können für einen Arzneimittelhersteller erheblich sein und bringt üblicherweise folgende Konsequenzen mit sich:
- Zurückhaltung der Freigabe und möglicherweise Entsorgung der Charge des Produkts, die die Prüfung nicht bestanden hat
- Zusätzliche Reinigung und Desinfektion der Produktionsbereiche
- Behördliche Intervention
- Finanzielle Verluste für Hersteller
- Rechtzeitige Ermittlungen
- Medikamentenknappheit für Patienten
- Einstellung der Produktion weiterer Produkte während der Durchführung von Untersuchungen
Allerding sind nicht bestandene Sterilitätsprüfungen nicht immer auf eine Kontamination des Produkts zurückzuführen.
Ein falsch positives Ergebnis kann auftreten, wenn eine Kontamination aus der Umgebung oder durch den Bediener, der den Test durchführt, in den Test gelangt und zu einem Fehler führt. Ein Produkt gilt als kontaminiert, obwohl es in Wirklichkeit frei von schädlichen Mikroorganismen ist.
Im Falle einer negativen Sterilitätsprüfung liegt die Beweislast beim Hersteller, der nachweisen muss, dass der Fehler auf eine Kontamination durch den Bediener und/oder die Laborumgebung zurückzuführen ist, was schwer zu beweisen ist. Infolgedessen führen falsch positive Ergebnisse häufig dazu, dass konforme und effektive Produkte unnötigerweise entsorgt werden.
Schützen Sie Ihren Betrieb mit einem Isolator für Sterilitätsprüfungen

Regulatorische Leitlinien zu Isolatoren:
- Im EU-GMP-Anhang 1, Abschnitt 10.6 heißt es:
„Die Sterilitätsprüfung sollte unter aseptischen Bedingungen durchgeführt werden“
- Die FDA-Leitlinien für die Industrie für sterile Arzneimittel, die durch aseptische Verfahren hergestellt werden, gehen noch einen Schritt weiter und legen in Abschnitt XI fest:
„Die Verwendung von Isolatoren für Sterilitätstests trägt dazu bei, die Wahrscheinlichkeit falsch positiver Testergebnisse zu minimieren.“
- Gemäß EU-GMP Anhang 1 ist ein Isolator:
„Ein Gehäuse, das einer reproduzierbaren biologischen Dekontamination des Innenraums unterzogen werden kann, mit einem inneren Arbeitsbereich, der die Bedingungen der Klasse A erfüllt und eine kompromisslose und kontinuierliche Isolierung des Innenraums von der äußeren Umgebung gewährleistet“

Isolatoren zeichnen sich durch eine Reihe von Schutzfunktionen ausAseptische Prozesse, einschließlich:
- luftdichte/aufblasbare Dichtungen an allen Türen
- Verriegelungen, die das Öffnen der Türen nach Erreichen der aseptischen Bedingungen (nach der Biodekontamination) verhindern
- unidirektionale Luftströmung zwischen 0,36 und 0,45 m/s (zur Einhaltung der Richtwerte des EU-GMP Anhangs 1)
- HEPA-Filter zur Reinigung der einströmenden Luft
- Druckdifferenzen, separate Druckprüfung von Gehäuse und Handschuhen
- Systeme für die Umgebungsüberwachung zur Gewährleistung, dass die Umgebung während der Verwendung aseptisch bleibt
- Luftstrom- und Druckalarme
- Wasserstoffperoxiddampf-Biodekontaminationssystem mit einer sporiziden Abtötung um 6 Log-Stufen* zur Eliminierung von Kontaminationen auf den Gehäuseoberflächen und den für den Prüfprozess benötigten Eingangsmaterialien
*Ecolab Bioquell-Systeme verwenden bei bestimmungsgemäßer Verwendung Bioquell Wasserstoffperoxid-Sterilant-AQ (EPA-Registrierungs-Nr.: 1677-277)
Vorteile von Isolatoren
In erster Linie reduzieren Isolatoren das Risiko falsch positiver Ergebnisse bei Sterilitätsprüfungen, wodurch die Hersteller steriler Produkte Millionen von Dollar einsparen können, da die unnötige Vernichtung von Produkten minimiert wird.
Als Nebeneffekt können Isolatoren auch zu erheblichen Einsparungen bei den Betriebskosten führen.
Im Gegensatz zu einer biologischen Sicherheitswerkbank (BSC) / Laminar Air Flow (LAF), die in einem Reinraum der Klasse B aufgestellt werden muss, können Isolatoren in einem Reinraum der Klasse C/D mit geringeren Anforderungen aufgestellt werden. Dies kann zu erheblichen Einsparungen führen:
- Energierechnungen aus HVAC-System mit geringerer Kapazität
- geringerer Arbeitsaufwand (für Reinigung und Desinfektion)
- weniger Wartung des Reinraums
- geringere Kosten für Reinigungs- und Desinfektionsmittel
- Weniger Anforderungen an die Schutzkleidung
- erhöhte Effizienz der Bediener, die aufgrund des reduzierten Aufwands hinsichtlich der Schutzkleidung länger arbeiten können
1Kosten für einen Reinraum pro Quadratfuß, Cleanroom Technology, 28. Februar 2018


Vergleich herkömmlicher Edelstahlisolatoren mit dem Bioquell Qube